
Das Hanseatische Oberlandesgericht hat im Rahmen eines unter dem Aktenzeichen 3 W 38/20 geführten Verfahrens, welches auf den Erlass einer einstweiligen Verfügung gegen einen Großhändler von Medicinal-Cannabis gerichtet war, mit Beschluss vom 22.12.2020 entschieden, dass es sich bei medizinischen Cannabisblüten nicht um Arzneimittel i.S.v. Art. 1 Ziffer 2 der Richtlinie 2001/83/EG bzw. § 2 Abs. 1 AMG handelt.
Solange die Cannabisblüten nicht mit konkreten Wirkungen beworben würden, handele sich bei diesen vielmehr lediglich um Stoffe i.S.v. Art. 1 Ziffer 3 RL 2001/83/EG bzw. § 3 Ziffer 2 AMG, da durch den abgebenden Apotheker noch diverse Verarbeitungsschritte vorgenommen, zumindest aber eine Identitätsprüfung durchgeführt werden müsste.
Damit kam das Hanseatische Oberlandesgericht zu dem Ergebnis, dass die Kennzeichnungsvorschrift des § 15 Abs. 1 der Arzneimittel- und Wirkstoffherstellungsverordnung (AMWHV) auf die streitgegenständlichen, in Kunststoffdosen verpackten Cannabisblüten der niederländischen Firma Bedrocan keine Anwendung finden würden.
Letztlich hat das Hanseatische Oberlandesgericht den Vertrieb der Cannabisblüten der Firma Bedrocan dann aber doch bezogen auf die konkrete Aufmachung untersagt, weil diese entgegen der Vorschrift des § 24 Abs. 2 AMWHV nicht mit dem Hersteller und dessen Anschrift gekennzeichnet waren.
Beschluss
In der Sache
- Antragsteller und Beschwerdeführer -
gegen
- Antragsgegnerin und Beschwerdegegnerin -
Prozessbevollmächtigte:
Rechtsanwälte Diekmann, Feldbrunnenstraße 57, 20148 Hamburg,
beschließt das Hanseatische Oberlandesgericht - 3. Zivilsenat - durch den Vorsitzenden Richter am Oberlandesgericht Schmidt, die Richterin am Oberlandesgericht Terschlüssen und die Richterin am Oberlandesgericht Brehmer am 22.12.2020:
I. Auf die sofortige Beschwerde des Antragstellers vom 11. Mai 2020 wird der Beschluss des Landgerichts Hamburg vom 22. April 2020, Az. 406 HKO 64/20, abgeändert:
Im Wege der einstweiligen Verfügung - der Dringlichkeit wegen ohne vorherige mündliche Verhandlung - wird der Antragsgegnerin bei Vermeidung eines vom Gericht für jeden Fall der Zuwiderhandlung festzusetzenden Ordnungsgeldes, und für den Fall, dass dieses nicht beigetrieben werden kann, einer Ordnungshaft oder einer Ordnungshaft bis zu sechs Monaten (Ordnungsgeld im Einzelfall höchstens € 250.000,00; Ordnungshaft insgesamt höchstens zwei Jahre) verboten,
im Rahmen geschäftlicher Handlungen zu Wettbewerbszwecken Cannabisblüten in nachfolgend abgebildeter Aufmachung in Verkehr zu bringen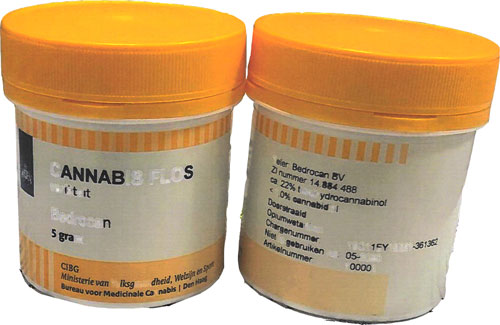
II. Die Kosten des Rechtsstreits trägt die Antragsgegnerin.
III. Der Wert des Beschwerdeverfahrens wird auf € 100.000,00 festgesetzt.
Gründe:
A.
Die sofortige Beschwerde des Antragstellers ist zulässig und begründet.
Das Landgericht hat den geltend gemachten Unterlassungsantrag zu Unrecht zurückgewiesen.
Der Antragsteller ist ein Wettbewerbsverband gemäß § 8 Abs. 3 Nr. 2 UWG (Anlagen ASt. 1 bis ASt. 5). Die Antragsgegnerin ist ein pharmazeutisches Großhandelsunternehmen, das über eine Genehmigung nach § 52a AMG, sowie über eine Erlaubnis nach § 3 BtMG zum Handel mit Betäubungsmitteln verfügt (Anlagen ASt. 7 und ASt. 8).
Die Parteien streiten über die Zulässigkeit des Vertriebs von Cannabisblüten in pharmazeutischer Qualität, in der aus dem Verfügungstenor ersichtlichen Aufmachung, in der die Antragsgegnerin das Produkt als Großhändlerin in der unveränderten Aufmachung des niederländischen Herstellers an deutsche Apotheken vertreibt (Anlagen ASt. 10, ASt. 21 und ASt. 22).
Seit Beginn der Verschreibungsfähigkeit von medizinischem Cannabis im März 2017 stammen sämtliche in der Bundesrepublik Deutschland verordneten Cannabisblüten entweder aus den Niederlanden oder aus Kanada. Die in den Niederlanden hergestellten bzw. angebauten Cannabisblüten stammen ausschließlich von dem Züchter Bedrocan B.V., der verschiedene Varietäten (Sorten), u.a. die Varietäten „Bedrocan“ und „Bedica“, zur Verfügung stellt. Der legale Vertrieb nach Deutschland erfolgt über das Centraal lnformatiepunt Beroepen Gesondheidszorg (CIBG), einer Agentur im Geschäftsbereich des niederländischen Gesundheitsministeriums (Ministerie van Volksgezondheit, Welzijn en Sport), die dem niederländischen Cannabisbüro (Bureau voor Medicinale Cannabis/OMC) zugeordnet ist. Das OMC ist in den Niederlanden die verantwortliche staatliche Stelle für die Herstellung von Medizinal-Cannabis und hat als verantwortliche staatliche Stelle das Monopol auf die Abgabe von Cannabis an Apotheken in den Niederlanden, aber auch für den Im- und Export von medizinischem Cannabis (Anlagen ASt. 9 und ASt. 20).
Die Cannabisblüten werden in weißen Kunststoffgefäßen mit einem gelben Deckel vertrieben. Die Behältnisse enthalten jeweils 5 Gramm Cannabisblüten und weisen ein in niederländischer Sprache gekennzeichnetes Etikett auf (siehe Abbildung im Verfügungstenor). Die deutschen Apotheken verwenden diese medizinischen Cannabisblüten zur Herstellung von Rezepturarzneimitteln.
Mit dem geltend gemachten Unterlassungsantrag wendet sich der Antragsteller gegen die Kennzeichnung, mit der die Antragsgegnerin medizinische Cannabisblüten („Cannabis Flos“) in Deutschland in Verkehr bringt. Er ist der Ansicht, dass die Angaben auf dem Etikett des Liefergefäßes nicht gesetzeskonform seien.
Im März 2020 hat der Antragsteller einen entsprechenden Testkauf veranlasst (Anlage ASt. 10). Wegen dieses lnverkehrbringens von Cannabisblüten - in der im Unterlassungsantrag wiedergegebenen Aufmachung - hat der Antragsteller die Antragsgegnerin mit Schreiben vom 3. April 2020 abgemahnt (Anlage ASt. 11). Die Antragsgegnerin hat die Abmahnung mit Schreiben vom 9. April 2020 zurückgewiesen (Anlage ASt. 12) und noch am selben Tag eine entsprechende Schutzschrift hinterlegen lassen. Unter dem 16. April 2020 hat der Antragsteller den vorliegenden Verfügungsantrag beim Landgericht Hamburg gestellt.
Der Antragsteller hat geltend gemacht, dass die Kennzeichnung mit der die Liefergefäße (Kunststoffdosen) versehen seien, nicht den gesetzlichen Anforderungen der§ 15 Abs. 1 bzw. § 24 Abs. 2 Arzneimittel- und Wirkstoffherstellungsverordnung (AMWHV) entspreche.
Bei den streitgegenständlichen medizinischen Cannabisblüten handele es sich um Arzneimittel, und zwar sowohl um Funktions- als auch um Präsentationsarzneimittel. Die Funktionsarzneimitteleigenschaft ergebe sich bereits aufgrund des in den Cannabisblüten enthaltenen Tetrahydrocannabinols (THC) und dessen Wirkungen. Die Blüten wirkten u.a. schmerzlindernd, so dass eine arzneiliche Wirkung vorliege. Er hat darauf hingewiesen, dass auch das Regierungspräsidium Darmstadt davon ausgehe, dass es sich bei Medizinal-Cannabisblüten um Arzneimittel handele (Anlage ASt. 13).
Arzneimittel, die zur Anwendung am Menschen bestimmt und keine Fertigarzneimittel seien, dürften nach § 15 Abs. 1 AMWHV in Deutschland nur dann in den Verkehr gebracht werden, wenn ihre Behältnisse und, soweit verwendet, die äußeren Umhüllungen nach § 10 Abs. 1 Nr. 1, 2, 4, 6 und 9 AMG in gut lesbarer Schrift, in deutscher Sprache und auf dauerhafte Weise gekennzeichnet seien. Diese Voraussetzungen erfüllten die von der Antragsgegnerin vertriebenen Produkte jedoch nicht.
So fehle die Angabe des pharmazeutischen Unternehmers, d.h. der Antragsgegnerin. Nach § 9 AMG müssten Arzneimittel, die in Deutschland in den Verkehr gebracht würden, den Namen oder die Firma und die Anschrift des pharmazeutischen Unternehmers tragen. Nach § 10 Abs. 1 S. 1 Nr. 1 AMG müsse diese Kennzeichnung auf dem Etikett erfolgen. Nach§ 4 Abs. 18 S. 2 AMG sei derjenige pharmazeutischer Unternehmer, der ein Arzneimittel in Deutschland unter seinem eigenen Namen in den Verkehr bringe. Dies sei hier die Antragsgegnerin, denn sie bringe das Produkt ausweislich der vorliegenden Lieferunterlagen unter ihrem Namen in Deutschland in Verkehr (Anlage ASt. 10). Die Bezeichnung der Cannabisblüten mit „Cannabis flos“ möge zu treffend sein, es fehle aber der Hinweis auf die Stärke und die Darreichungsform des Arzneimittels. Auch die Angabe zum Verfalldatum sei unzureichend, weil dieses Datum lediglich mit der Angabe „Niet te gebruiken na: 05-2020“ und nicht mit einer der beiden gesetzlich vorgesehenen Formulierungen, d.h. unter Verwendung der Angabe „verwendbar bis“ oder der Abkürzung „verw. bis“, mitgeteilt worden sei.
Selbst wenn es sich - wie nicht - bei den medizinischen Cannabisblüten lediglich um Wirkstoffe handele, sei die Kennzeichnung unzureichend, weil auch die für Zwischenprodukte und Wirkstoffe geltenden Anforderungen nach § 24 AMWHV nicht eingehalten worden seien. Denn auch nach dieser Regelung seien auf den Behältnissen der Hersteller, das Verfalldatum und die Notwendigkeit der Lagerung des Produkts bei Raumtemperatur, anzugeben, und zwar in deutscher Sprache.
Der Antragsteller hat beantragt,
der Antragsgegnerin bei Vermeidung der gesetzlichen Ordnungsmittel im Wege der einstweiligen Verfügung zu verbieten,
im Rahmen geschäftlicher Handlungen zu Wettbewerbszwecken Cannabisblüten in nachfolgend abgebildeter Aufmachung in Verkehr zu bringen
Das Landgericht hat den Verfügungsantrag mit Beschluss vom 22. April 2020 zurückgewiesen. Zur Begründung wurde ausgeführt, dass die fremdsprachige Kennzeichnung des streitigen Produkts nicht gegen § 15 AMWHV verstoße. Das Produkt sei Grundstoff eines erst noch herzustellenden Arzneimittels, selbst aber noch kein Arzneimittel. Eine deutschsprachige Kennzeichnung sei erst dann erforderlich, wenn das Produkt ohne Veränderungen an Inhalt, Verpackung oder Kennzeichnung an Patienten abgegeben werden solle. Dass das hier der Fall wäre, sei weder dargelegt noch sonst ersichtlich.
Auch ein Verstoß gegen § 24 AMWHV liege nicht vor. Das Produkt enthalte zwar den Wirkstoff THC, sei aber selbst kein Wirkstoff. Mangels relevanter Verarbeitungsschritte seien die Cannabisblüten auch kein Zwischenprodukt. Aber selbst wenn sie als Wirkstoff oder Zwischenprodukt anzusehen wären, seien keine Kennzeichnungsverstöße dargelegt. Die Verpflichtung zu deutschsprachigen Angaben nach § 24 Abs. 3 S. 2 AMWHV finde keine Anwendung, da das hier streitige Produkt unverändert ausgeliefert worden sei. Außerdem seien die in niederländischer Sprache erfolgten Angaben inhaltlich ausreichend. Verantwortlicher Hersteller sei das Büro für medizinisches Cannabis im Ministerium für Volksgesundheit als niederländisches Monopolunternehmen für medizinisches Cannabis, dessen Adresse mit „Den Haag“ für eine zuverlässige Erreichbarkeit (noch) ausreichend angegeben worden sei. Die Fa. Bedrocan B.V. sei lediglich der Züchter der Cannabisblüten. Als Verfalldatum sei der Mai 2020 zutreffend angegeben. Die Lagerung bei Raumtemperatur stelle keine besondere Lagerbedingung, sondern die übliche Form der Lagerung dar.
Hinsichtlich der näheren Einzelheiten wird auf den Beschluss des Landgerichts vom 22. April 2020 verwiesen.
Gegen diesen Beschluss wendet sich der Antragsteller mit seiner sofortigen Beschwerde vom 11. Mai 2020, mit der er den Erlass der beantragten Unterlassungsverfügung weiter verfolgt.
Er wiederholt und vertieft seinen bereits gehaltenen Vortrag. Er führt aus, dass medizinische Cannabisblüten auch deshalb Arzneimittel seien, weil sie als solche ohne weiteres geeignet seien, bei bestimmungsgemäßem Gebrauch physiologische Funktionen des Menschen in signifikanter Weise wiederherzustellen, zu korrigieren oder zu beeinflussen. Insoweit verweist der Antragsteller auf seinen erstinstanzlichen Vortrag zur Wirkung von THC und führt weiter aus, dass Cannabisblüten und Cannabisextrakte in Deutschland aufgrund ihrer pharmakologischen Wirkungen als Arzneimittel angewendet würden (Anlagen ASt. 15 bis ASt. 17).
Die Verordnung der streitgegenständlichen Cannabisblüten sei ohne einen weiteren in der Apotheke erfolgenden Be- oder Verarbeitungsschritt möglich (Anlagen ASt. 18 bis ASt. 20).
Der Antragsteller wiederholt den bereits erstinstanzlich gestellten Verfügungsantrag.
Die Antragsgegnerin beantragt,
die sofortige Beschwerde zurückzuweisen.
Zur Begründung führt die Antragsgegnerin aus, dass es sich bei den streitgegenständlichen medizinischen Cannabisblüten weder um ein Funktions- noch um ein Präsentationsarzneimittel handele. Es handele sich lediglich um ein Grundstoff im Sinne eines Vorprodukts bzw. einen Ausgangsstoff für die Herstellung von Rezepturarzneimitteln. Die Cannabisblüten seien allenfalls als Wirkstoff oder Arzneistoff anzusehen. Es handele sich um Stoffe i.S.v. § 3 Nr. 2 AMG.
Aus Sicht des Arzneimittelrechts bestehe der Unterschied zwischen einem Wirkstoff und einem Arzneimittel in seiner Zweckbestimmung. Ein Wirkstoff werde erst durch das Inverkehrbringen mit einem zielgerichteten diagnostischen oder therapeutischen Einsatz zum Arzneimittel.
Da noch wesentliche Verarbeitungsschritte in der Apotheke vorgenommen würden, nämlich die Prüfung und die Herstellung des entsprechenden Rezepturarzneimittels, handele es sich bei den Cannabisblüten (noch) nicht um Arzneimittel. Entscheidend für die Unterscheidung zwischen einem Arzneimittel und einem Vorprodukt für ein Rezepturarzneimittel sei vorliegend, dass die Cannabisblüten erst durch die Angabe der genauen Sorte sowie des THC- und des CBD-Gehalts sowie der vom Arzt verordneten Art der Verarbeitung (Zerkleinerung etc.) sowie Art und Dosis der Einnahme (Inhalation oder orale Gabe) zu einem Arzneimittel würden. Auf der Grundlage des individuell ausgestellten ärztlichen Rezepts erfolge in der Apotheke eine aufwendige Identitätsprüfung gemäß § 11 Abs. 2 ApoBetrO (Anlage AG 1 zum Schriftsatz vom 23. September 2020 / Bekanntmachung des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) zum Deutschen Arzneibuch 2018 vom 9. April 2018). Weiter erfolge in der Apotheke der eigentliche Herstellungsprozess, bei dem die Cannabisblüten zerkleinert, gesiebt und in jedem Fall abgepackt und erneut gekennzeichnet würden. Erst in der Apotheke werde aus den medizinischen Cannabisblüten gemäߧ 1 Abs. 8a Apothekenbetriebsordnung (ApBetrO) ein Rezepturarzneimittel hergestellt.
Bei den medizinischen Cannabisblüten handele es sich auf der Großhandelsebene, auf der die Antragsgegnerin tätig sei, um einen Wirkstoff i.S.v. § 4 Abs. 19 AMG. Pflanzen und Pflanzenteile unterfielen gemäß § 3 Nr. 2 AMG dem Stoffbegriff des AMG. Wirkstoffe seien nicht gemäß § 15 Abs. 1 AMWHV, sondern gemäß § 24 Abs. 2 AMWHV auf den äußeren Umhüllungen in gut lesbarer Schrift und auf dauerhafte Weise zu kennzeichnen. Die danach erforderlichen Angaben seien auf dem Etikett des niederländischen Herstellers vorhanden.
Selbst wenn - wie hier nicht - die Regelung von § 15 Abs. 1 AMWHV zur Anwendung käme, seien die danach erforderlichen Angaben gemäߧ 10 Abs. 1 Nrn. 1, 2, 4, 6 und 9 AMG vorhanden. Pharmazeutischer Unternehmer sei nicht die Antragsgegnerin, sondern die Fa. Bedrocan. Deren Name und Anschrift seien vorhanden. Die Bezeichnung des Produkts ergebe sich aus der Angabe „Cannabis flos“, denn dabei handele es sich um die internationale Bezeichnung von medizinischen Cannabisblüten, womit auch die Darreichungsform klargestellt sei. Die Stärke sei auf dem Etikett angegeben, und zwar mit „ca. 22% tetrahydrocannabinol, <1,0% cannabidiol“.
Auch die Chargennummer „19C11EY19E21-361361“ sei genannt und das Gewicht mit „5 gram“ angegeben worden. Die Angabe des Verfalldatums, ,,Niet te gebruiken na: 05-2020“, sei nicht zu beanstanden.
Soweit nach § 10 Abs. 1 Nr. 9 AMG verlangt werde, das Verfallsdatum unter Verwendung der Formulierung „Verwendbar bis“ bzw. „verw. Bis“ anzugeben, fehle der deutschen Regelung eine Grundlage in der RL 2001/83/EG. Nach Art. 54 lit. h) der RL 2001/83/EG werde lediglich ein „unverschlüsseltes Verfalldatum (Monat/Jahr)“ verlangt. Da die Mitgliedsstaaten nach Art. 60 RL 2001/83/EG das Inverkehrbringen von Arzneimitteln in ihrem Hoheitsgebiet nicht aus Gründen untersagen oder verhindern dürfen, die mit der Etikettierung zusammenhingen, sofern diese der RL entsprechen, sei die Verkehrsfähigkeit des Arzneimittels durch das Fehlen der wörtlichen Angabe „Verwendbar bis“ bzw. „verw. bis“ nicht beeinträchtigt.
Die Antragsgegnerin führt weiter aus, dass die Fa. Bedrocan die Cannabisblüten seit jeher mit der streitgegenständlichen Etikettierung vertreibe. Die Antragsgegnerin bringe die in den Niederlanden von der Fa. Bedrocan hergestellten und von der niederländischen Cannabisagentur freigegebenen medizinischen Cannabisblüten - wie alle anderen deutschen Großhändler - mit dem streitgegenständlichen Etikett auf den Markt (Anlage AG 2).
Hinsichtlich des weiteren Vorbringens der Parteien wird auf die zur Akte gereichten Schriftsätze einschließlich der Anlagen Bezug genommen.
B.
Die sofortige Beschwerde des Antragstellers ist zulässig und begründet.
1.
Der Verfügungsgrund liegt gemäߧ 12 Abs. 2 UWG vor. Der Antragsteller hat die Sache mit der gebotenen Eile zeitnah verfolgt.
II.
Darüber hinaus ergibt sich der Verfügungsanspruch aus§§ 3, 8 Abs. 1 und Abs. 3, 3a UWG i.V.m. § 24 AMWHV.
1.
Mit dem gestellten Verfügungsantrag wendet sich der Antragsteller gegen den Vertrieb der streitgegenständlichen medizinischen Cannabisblüten, und zwar mit der im Unterlassungsantrag wiedergegebenen Kennzeichnung.
Da sich der geltend gemachte Unterlassungsantrag gegen die konkrete Verletzungsform richtet, ist in dieser Verletzungsform der Lebenssachverhalt zu sehen, durch den der Streitgegenstand bestimmt wird. Der Antragsteller hat die konkrete Verletzungshandlung unter mehreren Gesichtspunkten beanstandet, ohne diese Beanstandungen in verschiedenen Klageanträgen zu umschreiben. Damit hat er es für den Fall eines Erfolgs seines Antrags dem Gericht überlassen, zu bestimmen, auf welchen der geltend gemachten Aspekt das Unterlassungsgebot gestützt wird (BGH, GRUR 2013, 401, Rn 24 - Biomineralwasser).
Das führt dazu, dass das Gericht die beanstandete Handlung - im Falle des Erfolgs des Antrags aufgrund eines der geltend gemachten Aspekte - hinsichtlich der weiter geltend gemachten Gesichtspunkte nicht mehr prüfen muss. Weiter führt dies dazu, dass insoweit keine kostenträchtige Teilzurückweisung zu erfolgen hat (vgl. BGH, GRUR 2013, 401, Rn. 25f. - Biomineralwasser).
2.
Der geltend gemachte Unterlassungsanspruch ist zwar nicht wegen eines Verstoßes gegen § 15 AMWHV begründet, er ergibt sich jedoch aus einem Verstoß gegen § 24 AMWHV.
a)
Entgegen der Ansicht des Antragstellers handelt es sich bei den streitgegenständlichen medizinischen Cannabisblüten nicht um Arzneimittel i.S.v. Art. 1 Ziffer 2 RL 2001/83/EG, § 2 Abs. 1 AMG. Es handelt sich vielmehr um Stoffe i.S.v. Art. 1 Ziffer 3 RL 2001/83/EG, § 3 Ziffer 2 AMG.
aa)
Nach Art. 1 Ziffer 2 RL 2001/83/EG (Gemeinschaftskodex für Humanarzneimittel) sind Arzneimittel alle Stoffe oder Stoffzusammensetzungen, die als Mittel mit Eigenschaften zur Heilung oder zur Verhütung menschlicher Krankheiten bestimmt sind (Art. 1 Ziffer 2 lit. a) RL 2001/83/EG) oder alle Stoffe oder Stoffzusammensetzungen, die im oder am menschlichen Körper verwendet oder einem Menschen verabreicht werden können, um entweder die menschlichen physiologischen Funktionen durch eine pharmakologische, immunologische oder metabolische Wirkung wiederherzustellen, zu korrigieren oder zu beeinflussen oder eine medizinische Diagnose zu erstellen (Art. 1 Ziffer 2 lit. b) RL 2001/83/EG). Nach§ 2 Abs. 1 AMG sind Arzneimittel Stoffe oder Zubereitungen aus Stoffen, die zur Anwendung im oder am menschlichen Körper bestimmt sind und als Mittel mit Eigenschaften zur Heilung oder Linderung oder zur Verhütung menschlicher oder tierischer Krankheiten oder krankhafter Beschwerden bestimmt sind (§ 2 Abs. 1 Ziffer 1 AMG/Präsentationsarzneimittel) oder die im oder am menschlichen Körper angewendet oder einem Menschen verabreicht werden können, um die physiologischen Funktionen durch eine pharmakologische, immunologische oder metabolische Wirkung wiederherzustellen, zu korrigieren oder zu beeinflussen (§ 2 Abs. 1 Ziffer 2a) AMG/Funktionsarzneimittel). Pflanzliche Arzneimittel sind nach § 4 Abs. 29 AMG Arzneimittel, die als Wirkstoff ausschließlich einen oder mehrere pflanzliche Stoffe oder eine oder mehrere pflanzliche Zubereitungen oder eine oder mehrere solcher pflanzlichen Stoffe in Kombination mit einer oder mehreren solcher pflanzlichen Zubereitungen enthalten.
Stoffe sind demgegenüber gemäß Art. 1 Ziffer 3 RL 2001/83/EG alle Stoffe jeglicher Herkunft, u.a. pflanzlicher Herkunft, wie z.B. Pflanzen, Teile von Pflanzen, Pflanzensekrete und durch Extraktion gewonnene Stoffe. Ein Wirkstoff ist nach Art. 1 Ziffer 3 RL 2001/83/EG jeder Stoff oder jedes Gemisch von Stoffen, der bzw. das bei der Herstellung eines Arzneimittels verwendet werden soll und im Fall der Verwendung bei seiner Herstellung zu einem Wirkstoff dieses Arzneimittels wird, das eine pharmakologische, immunologische oder metabolische Wirkung ausüben soll, um die physiologischen Funktionen wiederherzustellen, zu korrigieren oder zu beeinflussen, oder eine medizinische Diagnose erstellen soll. Nach § 3 Ziffer 2 AMG sind Stoffe u.a. Pflanzen, Pflanzenteile und Pflanzenbestandteile in bearbeitetem oder unbearbeitetem Zustand.
Nach § 4 Abs. 19 AMG sind Wirkstoffe solche Stoffe, die dazu bestimmt sind, bei der Herstellung von Arzneimitteln als arzneilich wirksame Bestandteile verwendet zu werden oder bei ihrer Verwendung in der Arzneimittelherstellung zu arzneilich wirksamen Bestandteilen der Arzneimittel zu werden. Es wird also auf die subjektive Zweckbestimmung des Herstellers abgestellt (Kügel/Müller/Hofmann, AMG, 2. Auflage, 2016, § 13 Rn. 12).
bb)
Das Arzneimittelgesetz enthält keine ausdrücklichen Regelungen darüber, ab welcher Produktionsstufe von einem Arzneimittel gesprochen werden kann. Es definiert neben Arzneimitteln die Stoffe (§ 3 AMG), die Wirkstoffe, die dazu bestimmt sind, bei der Herstellung von Arzneimitteln als arzneilich wirksame Bestandteile verwendet zu werden(§ 4 Abs. 19 AMG), und erwähnt daneben im Zusammenhang mit Fertigarzneimitteln die sog. Zwischenprodukte, die jedenfalls keine Fertigarzneimittel sind (§ 4 Abs. 1 Satz 2 AMG), sowie die Ausgangsstoffe von Arzneimitteln (§ 54 Abs. 2 Nr. 8 AMG). Daneben haben sich weitere Begriffsdefinitionen etabliert (etwa die Begriffe Rohstoff, Grundstoff und Bulkware, vgl. Kloesel/Cyran, AMG § 2 Anm. 21), die indes (ebenfalls) keine trennscharfe Abgrenzung ermöglichen. Auch die Regelungen des Arzneimittelgesetzes über Arzneimittel, die keine Fertigarzneimittel im Sinne des § 4 Abs. 1 AMG sind, sondern erst durch die Zubereitung des Apothekers ihre endgültige Abgabeform erlangen, liefern keinen eindeutigen Aufschluss. Zwar befreit das Gesetz Apotheker für die Herstellung von Arzneimitteln im üblichen Apothekenbetrieb von der Notwendigkeit einer Herstellungserlaubnis (§ 13 Abs. 2 Nr. 1 AMG). Daraus lässt sich allerdings nicht schließen, dass solche Arzneimittel in jedem Fall erst durch den Apotheker hergestellt werden, also zuvor noch keine Arzneimittel, sondern lediglich Ausgangsstoffe oder Zwischenprodukte vorliegen (BVerwG, PharmR 2011, 168, Rn. 15 - TCM-Granulate ).
Das Gesetz geht vielmehr von einem weiten Begriff des Herstellens aus. Nach § 4 Abs. 14 AMG ist darunter das Gewinnen, das Anfertigen, das Zubereiten, das Be- oder Verarbeiten, das Umfüllen einschließlich Abfüllen, das Abpacken, das Kennzeichnen und die Freigabe zu verstehen. Angesichts der Weite dieser Definition verbietet sich die Annahme, dass stets nur der letzte Produktionsschritt vor der Abgabe an den Endverbraucher zur Herstellung des Arzneimittels führt und davor lediglich Zwischenprodukte vorliegen, die nicht unter den Arzneimittelbegriff fallen. Das widerspräche zum einen der allgemeinen Verkehrsauffassung; denn es liegt auf der Hand, dass etwa ein Produkt, das nur noch in bestimmter Weise gekennzeichnet oder abgepackt werden muss, bevor es als Arzneimittel an den Endverbraucher abgegeben wird, bereits zuvor diese Eigenschaft haben kann. Vor allem aber widerspräche es dem Schutzzweck des Gesetzes, die Arzneimittelsicherheit zu gewährleisten, indem der Verkehr von Arzneimitteln besonderen Anforderungen unterworfen wird. Das ließe sich nicht erreichen, wenn stets nur der letzte Produktionsschritt vor der Abgabe an den Endverbraucher die Arzneimitteleigenschaft des Produktes begründete (BVerwG, PharmR 2011, 168, Rn. 16 - TCM-Granulate).
Das Bundesverwaltungsgericht hatte deshalb in seiner Rechtsprechung für die Unterscheidung zwischen Arzneimitteln und bloßen Vorprodukten - in Bezug auf Funktionsarzneimittel - zunächst darauf abgestellt, ab welcher Produktionsstufe die Bestimmung eines Anwendungszwecks im Sinne des § 2 Abs. 1 AMG möglich sei und erkennbar vorliege. Danach sollte es für die Anwendung des Arzneimittelrechts genügen, dass ein Stoff mit seiner Herstellung für arzneiliche Zwecke bestimmt sei. Ob bei der Weiterverarbeitung ein chemisch-physikalischer Prozess stattfinde, durch den ein völlig neuer Stoff entstehe, der schließlich erst am menschlichen Körper angewandt werde, sollte danach für die Einordnung als Arzneimittel unerheblich sein, solange für ein Produkt bereits im Zeitpunkt der Herstellung eindeutig feststehe, dass seine künftige Zweckbestimmung ausschließlich darin bestehe, durch Anwendung im menschlichen Körper - wenn auch erst im notwendigen Zusammenwirken mit einem anderen Stoff - arzneilichen Zwecken zu dienen (BVerwG, NJW 1985, 1410).
Nachfolgend hat das BVerwG jedoch ausgeführt, dass diese ausschließlich an der Zweckbestimmung orientierte Unterscheidung zwischen Arzneimitteln und Vorprodukten enger zu fassen sei. Es sei zu vermeiden, dass bei einem mehrstufigen Herstellungsprozess jede Art von Vorprodukten oder sogar Rohstoffe bereits dem Arzneimittelbegriff unterfielen, sobald ihre Bestimmung zur Weiterverarbeitung zu einem Mittel mit arzneilichem Zweck erkennbar sei. Der Gesetzgeber gehe davon aus, dass Vorstufen nicht allein deshalb bereits Arzneimitteleigenschaft hätten, weil sie zu einem Arzneimittel weiterverarbeitet würden. Aus diesem Grund fänden sich im Arzneimittelgesetz neben dem Arzneimittelbegriff Bestimmungen über Wirkstoffe, Zwischenprodukte oder Ausgangsstoffe sowie - bezogen auf pflanzliche Arzneimittel - über die Arzneimittel und die pflanzlichen Stoffe oder Zubereitungen, die sie enthalten (§ 4 Abs. 29 AMG). Um dieser im Gesetz angelegten Unterscheidung Rechnung zu tragen, könne es geboten sein, als begrenzendes Kriterium für die Arzneimitteleigenschaft von Produkten in einem mehrstufigen Herstellungsprozess darauf abzustellen, dass keine wesentlichen Bearbeitungsschritte bis zum abgabefertigen Endprodukt mehr erforderlich seien (BVerwG, PharmR 2011, 168, Rn. 18 - TCM-Granulate).
Nachfolgend hat das BVerwG diese Rechtsprechung bestätigt und dahingehend präzisiert, dass die Frage, ob bis zur Herstellung des abgabefertigen Endprodukts noch wesentliche Bearbeitungs- oder Aufbereitungsschritte erforderlich seien, anhand einer wertenden Gesamtbetrachtung des Herstellungsprozesses zu beantworten sei. Eine Bearbeitung oder Aufbereitung sei wesentlich, wenn sie nach der Verkehrsanschauung den Herstellungsprozess präge oder für die Anwendungsfertigkeit des Erzeugnisses von besonderer Bedeutung sei (BVerwG, PharmR 2018, 98 Rn. 27 - Import-Blutegel).
cc)
Dies zugrunde gelegt ist vorliegend mit überwiegender Wahrscheinlichkeit davon auszugehen, dass bei den streitgegenständlichen Cannabisblüten - zum Zeitpunkt des Vertriebs durch die Antragsgegnerin auf der Großhandelsebene - noch wesentliche Herstellungsschritte bis zum abgabefähigen Endprodukt ausstehen.
Maßgeblich für die rechtliche Beurteilung ist vorliegend der Vertrieb der streitgegenständlichen Cannabisblüten in pharmazeutischer Qualität zum Zwecke des legalen Vertriebs in Apotheken und der Herstellung legaler Rezepturarzneimitteln in Apotheken. Es ist mithin nicht auf solche Handlungen und Verwendungsmöglichkeiten abzustellen, die sich außerhalb des gesetzlichen vorgesehenen Rahmens für die legale Verwendung medizinischer Cannabisblüten bewegen.
Mit dem Gesetz zur Änderung betäubungsmittelrechtlicher und anderer Vorschriften vom 6. März 2017, das am 10. März 2017 in Kraft getreten ist, wurde die Verkehrs- und Verschreibungsfähigkeit von weiteren Cannabisarzneimitteln, z.B. von getrockneten Cannabisblüten in standardisierter Qualität, hergestellt.
Die Herstellung der entsprechenden Rezepturarzneimittel erfolgt gemäß § 6 ApoBetrO. Arzneimittel, die in der Apotheke hergestellt werden, müssen nach 6 Abs. 1 S. 1 ApoBetrO die nach der pharmazeutischen Wissenschaft erforderliche Qualität aufweisen. Gemäß § 6 Abs. 1 S. 2 ApoBetrO sind sie nach den anerkannten pharmazeutischen Regeln herzustellen und zu prüfen; enthält das Deutsche Arzneibuch (DAS) entsprechende Regeln, sind die Arzneimittel nach diesen Regeln herzustellen und zu prüfen. Im Hinblick auf die streitgegenständlichen Cannabisblüten gilt die Monographie „Cannabisblüten Cannabis flos“ des Deutschen Arzneibuchs. Danach hat die Prüfung der Identität mithilfe der Dünnschichtchromatographie, die Prüfung der Reinheit bzw. des Wirkstoffgehalts mithilfe der Flüssigchromatographie zu erfolgen. Darüber hinaus enthält die Monographie Hinweise zur Lagerung und Beschriftung von Cannabisblüten (Anlage A 1 zum Schriftsatz der Antragsgegnervertreter vom 23. September 2020). In Ergänzung des DAS hat der Deutsche Arzneimittel-Codex bzw. das Neue Rezeptur-Formularium (DAC/NRF) für die Verordnung von medizinischen Cannabisblüten bislang vier Rezepturformeln entwickelt, und zwar für „Cannabisblüten zur Inhalation nach Verdampfung“ (NRF 22.12), „Cannabisblüten in Einzeldosen zur Inhalation nach Verdampfung“ (NRF 22.13), „Cannabisblüten zur Teezubereitung“ (NRF 22.14) und „Cannabisblüten in Einzeldosen zur Teezubereitung“ (NRF 22.15). Zur Vorbereitung der vorgenannten Rezepturen werden Cannabisblüten in einer geschlossenen Kräutermühle grob gemahlen und anschließend gesiebt. Die Dosierung durch den Patienten erfolgt dann mithilfe eines Dosierlöffels. Verordnet der Arzt Einzeldosen, sind diese abzuwiegen, zu portionieren und in geeignete Behältnisse abzufüllen (vgl. Anlage ASt. 20).
(1)
Da im Hinblick auf die Herstellung der vorgenannten Rezepturarzneimittel mit dem Mahlen, Sieben, Dosieren und Abpacken in der Apotheke noch wesentliche Bearbeitungsschritte zu erfolgen haben, sind die streitgegenständlichen Cannabisblüten (noch) nicht als Arzneimittel, sondern als (Ausgangs-)Stoff nach§ 3 Ziffer 2 AMG, nämlich Pflanzen, Pflanzenteile und Pflanzenbestandteile in bearbeitetem oder unbearbeitetem Zustand, anzusehen.
(2)
Der Antragsteller hat allerdings vorgetragen, dass keine Pflicht bestehe, NRF-Rezepturen zu verordnen, sondern dass auch eine Verordnung von unzerkleinerten Cannabisblüten möglich sei. Insoweit nimmt der Antragsteller auf den Beitrag „Cannabis auf Rezept - Das müssen Apotheker zum Start wissen“, der vom 9. März 2019 stammt und auf der Webseite DAZ.online veröffentlicht worden ist (Anlage ASt. 20), Bezug. Die Antragsgegnerin ist dem entgegen getreten und hat ausgeführt, dass der Apotheker auf der Grundlage des individuellen ärztlichen Rezepts eine Identitätsprüfung vornehmen müsse und zudem die patientengerechte Aufbereitung und das Abpacken zwingende Voraussetzungen für die Abgabe des Rezepturarzneimittels seien.
Der Antragsteller hat seinen streitigen Vortrag zur legalen Verwendbarkeit der streitgegenständlichen Cannabisblüten schon nicht hinreichend glaubhaft gemacht, insbesondere ergibt sich die erforderliche Glaubhaftmachung nicht aus dem als Anlage ASt. 20 vorgelegten Beitrag aus der Zeitschrift DAZ.online.
Es kann daher nicht mit überwiegender Wahrscheinlichkeit festgestellt werden, dass es sich bei den streitgegenständlichen Cannabisblüten um Funktionsarzneimittel i.S.v. Art. 1 Ziffer 2 lit. a) RL 2001/83/EG bzw.§ 2 Abs. 1 Ziffer 2a) AMG handelt.
(2)
Die streitgegenständlichen Cannabisblüten stellen auch kein Präsentationsarzneimittel dar.
(2.1)
Das streitgegenständliche Erzeugnis erfüllt nicht die Voraussetzungen für ein Präsentationsarzneimittel im Sinne des § 2 Abs. 1 Nr. 1 AMG. Danach sind Arzneimittel u.a. Stoffe oder Zubereitungen aus Stoffen, die zur Anwendung im menschlichen Körper bestimmt sind und als Mittel mit Eigenschaften zur Heilung oder Linderung oder zur Verhütung menschlicher Krankheiten oder krankhafter Beschwerden bestimmt sind. Maßgebend ist insoweit, wie das Produkt gegenüber dem Verkehr aufgrund seiner stofflichen Zusammensetzung, seiner Aufmachung und der Art seines Vertriebs in Erscheinung tritt (BVerwG, NVwZ-RR 1995, 625 f.).
Ein Erzeugnis hat dann eine Zweckbestimmung als Arzneimittel, wenn es entweder ausdrücklich als ein solches Mittel bezeichnet wird oder aber sonst beim Verkehr, wenn auch nur schlüssig, aber mit Gewissheit der Eindruck entsteht, dass es in Anbetracht seiner Aufmachung Eigenschaften zur Heilung, Linderung oder Verhütung menschlicher Krankheiten haben müsse (BVerwG, PharmR 2009, 397, Rn. 21; EuGH, PharmR 2008, 59, juirs-Rn. 46 - Knoblauchkapseln; OVG Münster, PharmR 2020, 369, 372).
Maßgeblich für die Einordnung des Produkts ist seine an objektive Merkmale anknüpfende überwiegende Zweckbestimmung, wie sie sich für einen durchschnittlich informierten, aufmerksamen und verständigen Durchschnittsbetrachter darstellt. Die „Bestimmung“ des Produkts, also sein Verwendungszweck, erschließt sich aus der stofflichen Zusammensetzung des Produkts, seiner Aufmachung und der Art seines Vertriebes. Mit seinem Erscheinungsbild begründet das Produkt Erwartungen und Vorstellungen über seine Zweckbestimmung oder es knüpft an eine schon bestehende Auffassung der Verbraucherkreise über den Zweck vergleichbarer Mittel und ihrer Anwendung an. Dabei kann die Vorstellung der Verbraucher auch durch die Auffassungen der pharmazeutischen oder medizinischen Wissenschaft beeinflusst sein (BVerwG, NVwZ-RR 1995, 625, 626 BGH, GRUR 2001, S. 450, 451 - Franzbranntwein; OVG Münster, PharmR 2020, 369, 372).
Für die Bewertung des Erscheinungsbildes eines Produkts sind insbesondere seine Bezeichnung, die Gestaltung von Verpackung oder Beipackzettel mit Hinweisen auf pharmazeutische Forschungen oder ärztliche Methoden oder Zeugnisse sowie die dem Hersteller zurechenbare Veröffentlichungen oder Werbung, auch im Internet, in den Blick zu nehmen. Hierbei genügt es nicht, wenn ein Produkt mit Eigenschaften präsentiert wird, die allgemein gesundheitsfördernde Wirkung haben. Vielmehr muss das Produkt heilende, krankheitsvorbeugende oder Leiden lindernde Wirkungen in Anspruch nehmen (BVerwG, NVwZ 2008, 439, Rn. 40 - OPC; BVerwG, NVwZ-RR 2007, 771, Rn. 23 - Pferdesalbe BVerwG, PharmR 2009, 397, Rn. 23 - Red Rice; OVG Münster, PharmR 2020, 369, 372).
(2.2)
Daran fehlt es vorliegend, denn die Antragsgegnerin vertreibt die streitgegenständlichen Cannabisblüten ohne Angaben zur Herstellung, zur Verordnung und Anwendung von Cannabisblüten sowie zu den vorliegenden wissenschaftlichen Erkenntnissen zu machen (Anlage ASt. 8). Auch auf den streitgegenständlichen Behältnissen fehlt es an solchen Angaben.
Allein der Umstand, dass es sich bei den streitgegenständlichen Cannabisblüten um solche von pharmazeutischer Qualität handelt und dies den angesprochenen Verkehrskreisen bekannt ist, genügt nicht um ein Präsentationsarzneimittel anzunehmen.
Mithin liegt auch kein Präsentationarzneimittel i.S.v. Art. 1 Ziffer 2 lit. a) RL 2001/83/EG bzw.§ 2 Abs. 1 Ziffer 1 AMG vor.
Es kann somit nicht mit überwiegender Wahrscheinlichkeit davon ausgegangen werden, dass es sich bei den streitgegenständlichen Cannabisblüten um Arzneimittel handelt.
Dem steht nicht entgegen, dass sich das Regierungspräsidium Darmstadt dahingehend geäußert hat, dass es sich bei Medizinal-Cannabisblüten um ein Arzneimittel handele. Zum einen vermag das als Anlage ASt. 13 vorgelegte Merkblatt des Regierungspräsidiums Darmstadt (Hessen) mit Stand vom Januar 2017 schon keine Rechtswirkungen im Hinblick auf die in Hamburg ansässige Antragsgegnerin zu entfalten. Zum anderen entspricht die Annahme des Regierungspräsidiums Darmstadt, wonach vor Abgabe an den Patienten keine Veränderung der Cannabisblüten erfolge, nicht dem hiesigen Sach- und Streitstand.
Da es sich bei den streitgegenständlichen Cannabisblüten nicht um Arzneimittel i.S.v. Art. 1 Ziffer 2 lit. a) und b) RL 2001/83/EG, § 2 Abs. 1 Ziffern 1 und 2a) AMG handelt, findet § 15 AMWHV keine Anwendung.
dd)
Da es sich bei den Cannabisblüten - wie oben ausgeführt - um einen Stoff nach Art. 1 Ziffer 3 3. Spiegelstrich RL 2001/83/EG bzw. § 3 Ziffer 2 AMG, nämlich Pflanzen, Pflanzenteile und Pflanzenbestandteile in bearbeitetem oder unbearbeitetem Zustand, handelt, ist jedoch § 24 AMWHV anwendbar.
Diesen Anforderungen genügt die Kennzeichnung der streitgegenständlichen Produkte - entgegen der Ansicht des Landgerichts - nicht.
(1)
Nach § 24 AMWHV sind Zwischenprodukte und Wirkstoffe der vorliegenden Art vor ihrem Inver kehrbringen auf ihren Behältnissen in gut lesbarer Schrift und auf dauerhafte Weise mindestens wie folgt zu kennzeichnen:
- Name oder Firma und zusätzlich Anschrift des Herstellers,
- Bezeichnung oder ldentifizierungscode des Produkts, soweit möglich auch seines Reinheitsgrades;
- Inhalt nach Gewicht;
- Chargenbezeichnung,
- Verfalldatum;
- besondere Transport- oder Lagerbedingungen, soweit für die Aufrechterhaltung der Qualität des Wirkstoffs oder Stoffs erforderlich.
Nach § 24 Abs. 3 AMWHV ist weiter, für den Fall, dass das Zwischenprodukt oder der Wirkstoff nachträglich von einem anderen Betrieb als dem Originalhersteller umgefüllt, umverpackt, umgekennzeichnet oder freigegeben wurde, zusätzlich der Name oder die Firma und die Anschrift dieses Betriebs sowie die neue Chargenbezeichnung auf dem Behältnis und, soweit verwendet, der äußeren Umhüllung des Zwischenprodukts oder des Wirkstoffs anzugeben. Diese Angaben sind in deutscher Sprache zu machen, sofern das Zwischenprodukt oder der Wirkstoff im Geltungsbereich des Arzneimittelgesetzes in den Verkehr gebracht wird.
(2)
Vorliegend sind zwar die Angaben zur Bezeichnung und zur Darreichungsform („Cannabis flos“), zum Reinheitsgrad („ca. 22% tetrahydrocannabinol, <1,0% cannabidiol“), zum Inhalt nach Gewicht („5 gram“), zur Chargenbezeichnung („19C11EY19E21-361361“) und zum Verfalldatum („Niet te gebruiken na: 05-2020“) vorhanden. Diese Angaben müssen - entgegen der Ansicht des Antragstellers - nicht in deutscher Sprache angebracht werden, denn die Voraussetzungen von 24 Abs. 3 AMWHV liegen hier nicht vor. Da die Lagerung bei Raumtemperatur keine besonderen Lagerbedingungen darstellt, ist insoweit keine nähere Angabe erforderlich.
Es fehlt allerdings die gemäß § 24 Abs. 2 Ziffer 1 AMWHV erforderliche Angabe des Herstellers und seiner Adresse.
Hersteller der streitgegenständlichen Cannabisblüten ist nicht das Gesundheitsministerium der Niederlande, sondern die Fa. Bedrocan B.V. Das ergibt sich zum einen aus dem vorliegenden „Certificate of GMP Compliance of a Manufacturer“ vom 23. Januar 2018, in dem das Gesundheitsministerium der Niederlande die Fa. „Bedrocan B.V.“ ausdrücklich als „Manufacturer“, d.h. als Hersteller, bezeichnet (Anlage ASt. 22). Zum anderen steht dies im Einklang mit § 4 Abs. 14 AMG, wonach das Gewinnen, das Anfertigen, das Zubereiten, das Be- oder Verarbeiten, das Umfüllen einschließlich Abfüllen, das Abpacken, das Kennzeichnen und die Freigabe als Herstellen anzusehen ist. Auch die Adressangabe ist unzureichend. Die Fa. Bedrocan B.V. hat ihren Sitz nicht in Den Haag, sondern in Veendam (Anlage ASt. 22). Zudem wäre auch die bloße Angabe der Stadt, ohne die weitere Angabe der Straße und der Postleitzahl, ungenügend.
Mithin ist der geltend gemachte Unterlassungsanspruch gemäß §§ 3, 8 Abs. 1 und Abs. 3, 3a UWG i.V.m. § 24 Abs. 2 Nr. 1 AMWHV begründet.
II.
Die Kostenentscheidung beruht auf§ 91 Abs. 1 ZPO. Die Festsetzung des Beschwerdewerts erfolgt nach § 51 Abs. 2 GKG.
